A Certificação de Equipamentos sob Regime de Vigilância Sanitária é um processo fundamental para garantir a segurança, a eficácia e a conformidade dos equipamentos utilizados em procedimentos de diagnóstico, tratamento e monitoramento de saúde. No Brasil, as principais regulamentações que regem esse processo são a Portaria Inmetro n° 384/2020 e a Anvisa RDC n° 751/2022.
Essas portarias são regulamentos importantes no Brasil, cada uma em sua respectiva área de atuação:
Portaria Inmetro 384/2020
A Portaria 384/2020 do Instituto Nacional de Metrologia, Qualidade e Tecnologia (Inmetro) estabelece regras para a avaliação da conformidade de produtos e serviços no Brasil. O principal objetivo é garantir a segurança e a qualidade de produtos disponíveis no mercado brasileiro. Esse regulamento é voltado principalmente para fabricantes e importadores, abrangendo:
- Definição de requisitos técnicos.
- Procedimentos para certificação.
- Critérios para a etiquetagem e informações que devem ser fornecidas ao consumidor.
Essa portaria é um dos documentos que fazem parte do sistema brasileiro de conformidade, que busca evitar a comercialização de produtos perigosos ou inadequados para o uso.
RDC Anvisa 751/2022
A Resolução da Diretoria Colegiada (RDC) nº 751/2022 da Agência Nacional de Vigilância Sanitária (Anvisa) dispõe sobre os requisitos sanitários para dispositivos médicos (produtos para saúde). Este regulamento se aplica a:
- Classificação dos dispositivos médicos em diferentes classes de risco.
- Requisitos para registro, cadastro e notificação de produtos.
- Controle de qualidade e segurança desses dispositivos no mercado.
- Exigências sobre rotulagem e instruções de uso.
A RDC 751/2022 visa assegurar que os dispositivos médicos disponíveis no Brasil sejam seguros, eficazes e de qualidade para o uso humano, contribuindo para a proteção da saúde pública.
Esses dois regulamentos são fundamentais para garantir a qualidade e a segurança tanto de produtos quanto de dispositivos médicos, dentro de suas respectivas jurisdições.
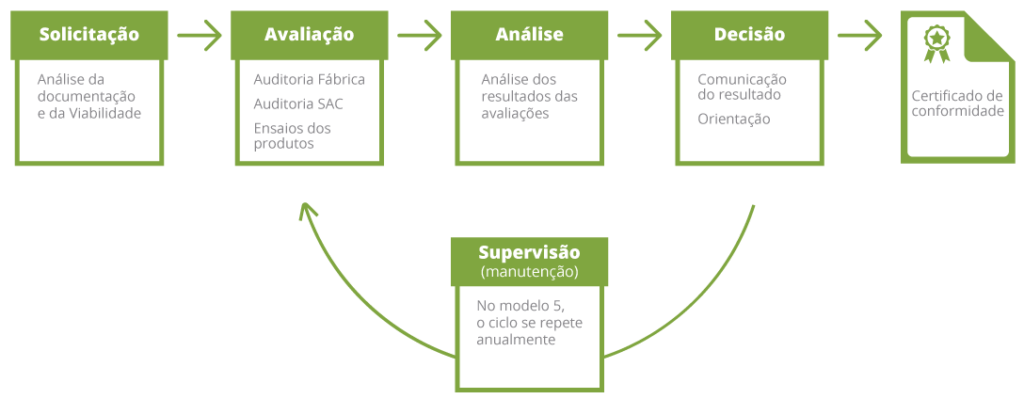
Etapas do processo
De forma simplificada, abaixo estão listadas as principais etapas do processo de certificação para este escopo.
Processo de Certificação – Modelo 5
Solicite seu orçamento abaixo:
Acesse e preencha o formulário deste link, para que possamos providenciar uma proposta técnico-comercial.
Qualquer dúvida relacionada ao preenchimento pode ser descrita no campo observações. Você também pode falar com um de nossos colaboradores, através dos canais de comunicação abaixo:
• Telefone: (48) 3029-3994
• E-mail: ocp@scitec.com.br
Através do Registro de Manifestação, é possível realizar uma Reclamação, Apelação ou Denúncia, referente aos nossos serviços ou aos produtos certificados por nós.
Caso haja alguma Dúvida ou Sugestão relacionada aos processos de certificação, também pode ser utilizado o mesmo formulário.
Referências normativas
IEC 60601: – A Estabelece os requisitos gerais para a segurança básica e desempenho essencial de equipamentos médicos elétricos.
ISO 13485:– Define os requisitos para um sistema de gestão da qualidade para produtos médicos.
Legislação brasileira: – Portaria INMETRO 384/2020 e ANVISA RDC 751/2022, além do Código de Defesa do Consumidor e da Lei Geral de Saúde.

